オンコリスバイオファーマは食道がん患者を対象としたPhaseⅠ臨床試験の治験実施申請を医薬品医療機器総合機構(PMDA)へ提出
- 2017/3/15 06:54
- 株式投資ニュース

■テロメライシンの安全性・有効性・腫瘍免疫応答の評価を実施する予定
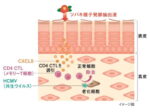
オンコリスバイオファーマ<4588>(東マ)は、国内で同社初となる腫瘍溶解ウイルス テロメライシン(OBP‐301)の企業治験を実施するため、食道がん患者を対象としたPhaseⅠ臨床試験の治験実施申請を医薬品医療機器総合機構(PMDA)へ提出した。
本試験では、外科手術による切除や根治的化学放射線療法が困難な食道がん患者を対象として、放射線治療併用によるテロメライシンの安全性・有効性・腫瘍免疫応答の評価を実施する予定。国内では、既に、岡山大学藤原俊義教授による同疾患を対象としたテロメライシンと放射線の併用に関する医師主導臨床研究が進行しているが、今回のPhaseⅠ臨床試験は、同社が実施する企業治験となる。
テロメライシンは米国で各種固形がんを対象とするPhaseⅠ臨床試験が完了しており、その安全性が確認された。また、一部の症例ではテロメライシン投与部位で腫瘍の縮小効果と腫瘍免疫反応が認められ、更に、遠隔効果を示唆する非投与部位での腫瘍縮小が観察された。
現在、海外では台湾・韓国で肝細胞がんを対象としたPhaseⅠ/Ⅱ臨床試験が進行中のほか、平成28年8月には米国食品医薬品局(FDA)に対し、悪性黒色腫(メラノーマ)を適応症とするPhaseⅡ臨床試験開始のためのプロトコル申請を実施している。
また、国内では先述の岡山大学での食道がんを対象とした医師主導臨床研究が進行すると共に、国立がん研究センター東病院と、進行性又は転移性固形がん患者を対象とした他の治療法との併用による効果検討に関する医師主導治験契約の締結を決定している。
本臨床試験は、テロメライシンに関し日本国内で実施される初めての企業治験となる。同社は、「がんを切らずに治す」というコンセプトに基づき開発を進めているテロメライシンと他の治療法との併用に関する研究開発を進めていくことで、医療現場の一助となるがん治療法の発展に貢献していくことを、今後も目指している。
なお、本件による平成29年12月期業績への影響はない。また、平成29年12月期中に、本企業治験のPhaseⅠ臨床試験推進を目的とした、希薄化を伴う新たな資金調達予定もないとしている。